
10月15日国家药监局发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》、《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》。至此,千呼万唤始出来的注射剂一致性评价技术文件终于出台。
政策下发,促进注射剂一致性评价加速
注射剂一致性评价一直是行业的热门话题,此前国家也陆续出台了相关文件。
2017年10月,两办发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,明确提出,“根据药品科学进步情况,对已上市药品注射剂进行再评价,力争用5至10年左右时间基本完成”。
2017年12月,药审中心发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,对参比制剂的选择、处方工艺技术要求、质量研究与控制技术要求等提出意见。不过正式稿一直未正式发出。
2018年3月,药审中心对《药物注射剂研发技术指导意见》公开征求意见。
而从CDE发布的第21批参比制剂目录开始,第一次出现注射剂,到目前为止,共涉及 625个注射剂。这也预示着注射剂一致性评价工作正在不断加快脚步。
注射剂近6000亿市场,企业积极参与一致性评价
米内网数据显示,2017年中国公立医疗机构终端注射剂市场接近6000亿元。公开数据显示,注射剂在我国样本医院占比超60%,单看西药领域,注射剂占比接近70%。
可见,注射剂再评价是各企业必争的领域,从受理号来看,注射剂一致性评价在近两年也呈高速增长态势。
据药智数据库显示,截止目前,注射剂一致性评价申报获受理的受理号共计有434个(120个品种)。
其中注射用头孢曲松钠竞争尤为激烈,有20个受理号获受理,涉及6家企业,是目前注射剂申报受理号最多的品种,其次是盐酸氨溴索注射液和注射用帕瑞昔布钠均有7家企业的15个受理号。
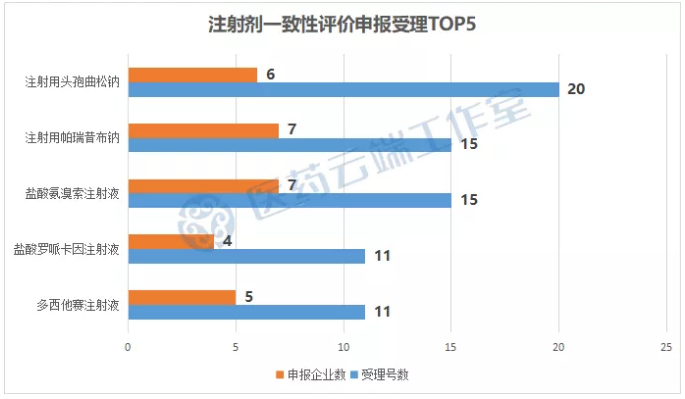
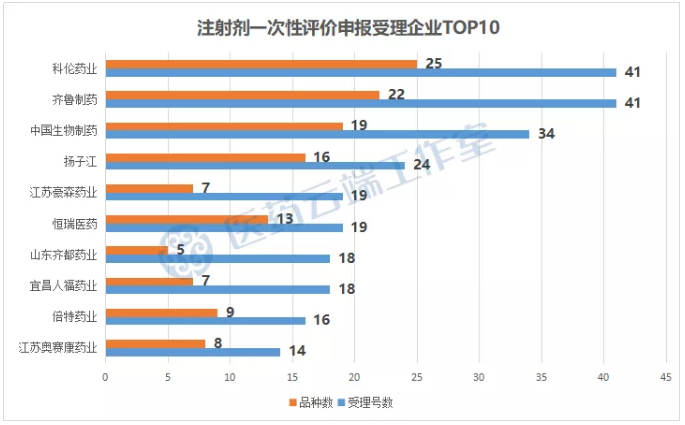
从申报企业来看,科伦药业作为大输液龙头企业,注射一致性评价申报当仁不让,以41个受理号25个品种遥遥领先,齐鲁制药也不甘落后,有41个受理号22个注射剂品种,其次是中国生物制药,34个受理号19个品种。
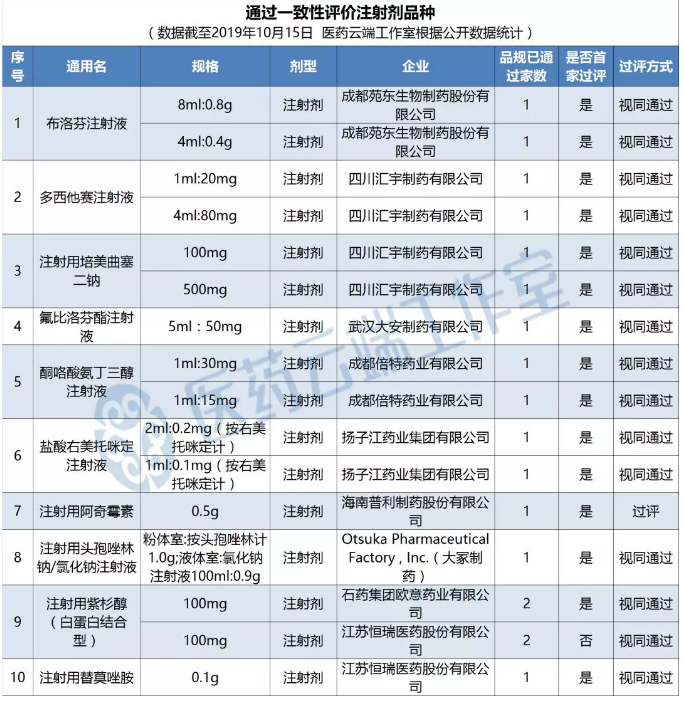
目前国内注射剂过评药品10个,涉及16个品规
根据医药云端工作室统计,截至目前,注射剂过评药品有10个,涉及16个品规,其中按“通过质量和疗效一致性评价的药品”收录进上市药品目录集的只有普利制药的注射用阿奇霉素,其他均为视同过评。
注射剂一致性评价面临的问题(九问九答)
10月15日,药监局发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》,时隔两年,注射剂一-致性评价再次启动。这将逐步影响千亿级别的注射剂市场。
国盛医药张金洋团队对此作出了分析:
1、整体来看,注射剂一致性评价的标准算高还是算低?
整体来看,注射剂一致性评价的标准算高的,基本是往美国方向的注册要求靠,但个别要求与美国的要求又不太相同,如金属离子络合剂和pH调节剂可以与参比制剂不同,在美国只有抑菌剂、缓冲剂和抗氧剂作为例外辅料。
2、这次征求意见稿与17年底的基本相同,这两年产业里到底经历了什么样的探讨与博弈?
这次征求意见稿与17年底的基本相同,在细节上进行了调整,具体如下:1)处方中辅料种类和用量:业内的博弈是已获批注射剂的辅料种类和用量,很多与参比制剂不一致,可能有些企业会希望在抑菌剂、缓冲剂等之外增加允许不同的辅料种类。这次征求意见稿除了之前提到的抑菌剂、缓冲剂、pH调节剂之外,还增加了金属离子络合剂。
2)灭菌工艺验证:之前的征求意见稿中只是提到了国内的国内灭菌/无菌工艺验证指导原则进行,这次增加了国外的灭菌/无菌工艺验证指导原则。国外的灭菌工艺与国内不完全相同,对于国内外共线理念生产的企业在灭菌工艺验证时都会同步考虑符合国内外的法规要求,与国际接轨,兼并最严格的法规要求。
3)这次征求意见稿,比上版区别,最大的看点,仅保留了改规格,并要求科学性等一堆理由,而改剂型,改盐根直接从文件中,移走,应该与美国接轨,改剂型,改盐根属于505(b)(2),研发时要上临床。
3、从各种细节来看,这次注射剂一致性评价的难点到底在哪里?
1)难点一:包材相容性研究2018年发布的《化学药品与弹性体密封件相容性研究技术指导原则(试行)》指导原则,其中提取介质、提取物研究和浸出物研究对设备要求比较高(气质、液质)、方法开发和方法验证需要的工作量较大,难度系数较大。
2)难点二:致突变杂质研究自2006年欧盟发布致突变杂质相关的指南以来,潜在的致突变杂质一直被业界关注,其控制限度低,对检测设备要求比较高(气质、液质),方法开发和方法验证上难度较大,在现阶段,原料药中一般都会考虑进行分析评估潜在杂质,视评估结果制定合理控制策略,且制剂方对于入厂原料药可能存在的致突变杂质还需考虑进行定期风险监控,目前,即使在制剂生产工艺、产品降解途径进行理论分析,在制剂中存在潜在杂质的可能性不大的情况下,必要时还需进行针对性研究。
3)难点三:包装系统密封性研究包装系统密封性采用微生物入侵法或染色法,对于效期比较长的品种,到效期末,微生物入侵法可能会有一定的挑战。目前可采用物理完整测试方法(例如压力/真空衰减等)进行检测,并进行方法学验证。采用物理完整性测试方法,相比微生物入侵法,对于效期内的包装系统密封性检测方法具有便捷性,但对于方法验证目前尚有难度,需要持续关注。
4、这次的文件会带来怎么样的产业洗牌?
按美国申报要求申报国内市场的品种通过注射剂一致性评价的可能性还是比较大的,欧盟申报的产品也没有明确要求一定要与原研处方相同,因此按欧盟申报要求申报的品种也不一定会与原研处方相同。对于早之前报批的,配方与原研不一致的注射剂,基本上都要面临处方调整和重新开发的困局。
5、已经申报一致性评价的注射剂品种会如何处理?
如已经申报的品种,能符合注射剂一致性评价要求,会继续审评的可能性较大
6、欧美共线品种要如何处理?是否之前停滞的现场核查会继续下去?
由于美国申报要求比欧盟的高,且注射剂一致性评价要求往美国方向靠,因此美国共线品种相比欧盟共线品种,具有一定的优势,从经历过的共线产品报国内市场的经验看,中国是申报难度系数最大的国家。参照2019年05月06日发布的《关于提交药品注册检查检验用申报资料光盘的通知》,中心在尝试提高审评审批效率,优化审评与检查检验衔接流程的更有效方法,之前停滞的现场核查继续下去的可能性较大。
7、已经有部分按照新3类或者4类获批的注射剂仿制药,未来需要重新审核么?
根据2019年10月15日发布的已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿),其中一致性评价资料要求按照《化学药品新注册分类申报资料要求(试行)》(2016年第80号)撰写,新分类执行后就是按照《化学药品新注册分类申报资料要求(试行)》(2016年第80号)提交资料,另外,按新分类获批的产品也视同通过一致性评价。因此按照新3类或者4类获批的产品,未来需要重新审核的可能性不大。
8、大概做一个品种的注射剂一致性评价会需要花费多少钱?注射剂一致性评价要不要做BE与验证性临床?
一个品种的注射剂一致性评价费用其实不同的品种相差是很远的,普通品种由于原料药,批量大小、杂质不同至少在500万~3000万左右不等,是否要做BE与验证性临床,视品种情况而定,如对应品种的进口原研已在国内上市,需要做BE与验证性临床的可能性不大。
9、这次文件里把“不建议使用低硼硅玻璃和钠钙玻璃”的说法去掉了,改为“注射剂使用的包装材料和容器的质量和性能不得低于参比制剂,以保证药品质量与参比制剂一致”,是否意义上仍然一样?
把“不建议使用低硼硅玻璃和钠钙玻璃”的说法去掉了,改为“注射剂使用的包装材料和容器的质量和性能不得低于参比制剂,以保证药品质量与参比制剂一致”,一定程度上理解,是稍微降低了要求的,但是仍然注射剂一致性评价的启动就是对于注射剂包材的洗牌。对于很早上市的原研药,可能还在沿用低硼硅玻璃和钠钙玻璃容器的情况,对于此类品种,即便原研使用的是低硼硅玻璃和钠钙玻璃,也不能使用低硼硅玻璃和钠钙玻璃作为品种容器包装材料,去掉之后,从字面理解,是可以继续用的。